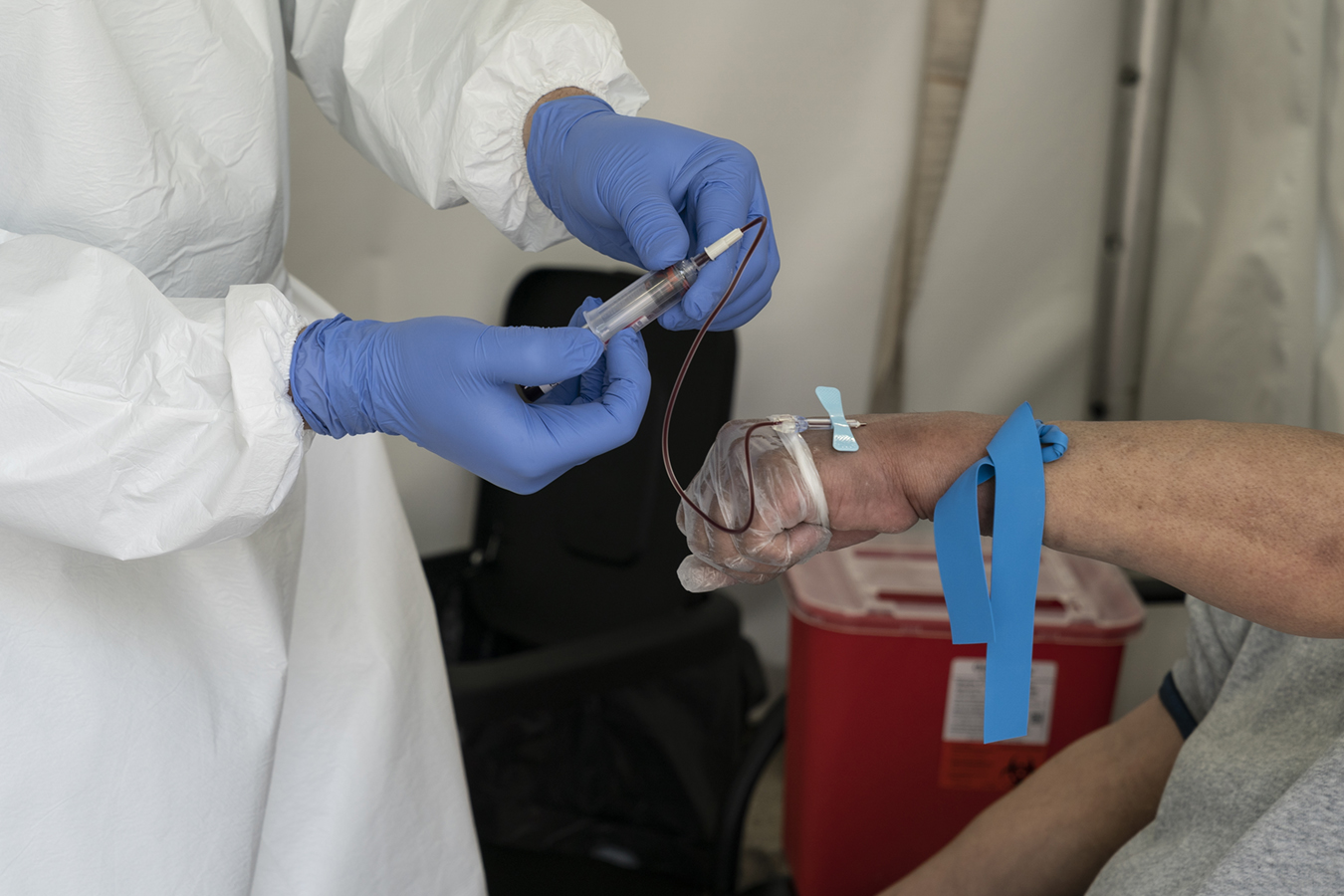
"Salva tu negocio mientras salvas vidas", se lee en el sitio web de Since Health , una startup tecnológica de Seattle que vende dos tipos de pruebas a empleadores dispuestos a pagar $ 350 por pop para saber si sus trabajadores han sido infectados con COVID-19.
El plan de "Salud en el lugar de trabajo" incluye no solo pruebas de frotis nasales para detectar infecciones, sino también análisis de sangre destinados a indicar si los trabajadores han desarrollado anticuerpos contra el virus y, posiblemente, protección futura.
"Hay una enorme demanda de los consumidores", dijo el Dr. Lars Boman, director médico de la firma con sede en Boston. “¿Pueden volver al trabajo? ¿Pueden volver a la vida?
Sin embargo, lo que el sitio web no deja claro es que los funcionarios de salud pública han advertido explícitamente que las pruebas de anticuerpos no deben usarse para tomar decisiones sobre la dotación de personal en el lugar de trabajo.
Registrarse por correo electrónico
Suscríbase a la sesión informativa matutina gratuita de KHN.
"Esta es una elección personal del negocio, del consumidor", dijo Boman.
En todo Estados Unidos, un número incontable de empleadores, empleados y ciudadanos comunes está recurriendo a una serie de nuevos análisis de sangre COVID-19, a veces costosos. Los científicos dicen que saber quién ya ha sido infectado podría tener implicaciones importantes para comprender la propagación de la enfermedad. Pero las serias preguntas sobre la precisión de algunas de las pruebas de serología, y la utilidad de los resultados que proporcionan, han llevado a la Administración Federal de Alimentos y Medicamentos a tratar de controlar lo que varios expertos en enfermedades infecciosas describieron como "el salvaje y salvaje oeste" de prueba de anticuerpos.
"Parece que las empresas surgieron de la noche a la mañana importando estas pruebas y distribuyéndolas", dijo el Dr. Michael Busch, director del Instituto de Investigación Vitalant sin fines de lucro en San Francisco. "Es indignante que la gente intentara ganar dinero con este miedo".
Más de 200 pruebas han inundado el mercado en cuestión de semanas, prometiendo detectar anticuerpos, que son proteínas que se desarrollan en la sangre como parte de la respuesta inmune del cuerpo a un virus invasor. Estos son diferentes de las pruebas moleculares, generalmente realizadas con hisopos nasales, utilizados para diagnosticar la infección.
Hasta el 1 de junio, solo 15 pruebas de anticuerpos habían recibido "autorizaciones de uso de emergencia" de la FDA, lo que permite que las pruebas que no se hayan investigado por completo se utilicen en una crisis. Incluso ese estándar se ha convertido en un punto de venta para algunas grandes empresas, como LabCorp y Quest Diagnostics , que enfatizan que se basan en pruebas que han recibido el visto bueno de la FDA.
A fines de mayo, la FDA eliminó más de 30 pruebas de serología de una lista de kits disponibles en el mercado, diciendo que "no deberían distribuirse" para la venta. La eliminación podría ser el resultado de que un fabricante no presente una solicitud de autorización de uso de emergencia dentro de un "período de tiempo razonable", o si la prueba muestra "problemas significativos" que no se pueden abordar o no se han abordado de manera oportuna, dijo la agencia. La forma de ejecución sigue sin estar clara.
El mes pasado, los CDC emitieron nuevas pautas advirtiendo que, dada la baja prevalencia del virus en la población general, incluso las pruebas más precisas podrían estar equivocadas la mitad del tiempo.
"Los resultados de las pruebas serológicas no deben usarse para tomar decisiones sobre la agrupación de personas que residen o son admitidas en entornos congregados, como escuelas, dormitorios o instalaciones correccionales", establecen las pautas. "Los resultados de las pruebas serológicas no deben usarse para tomar decisiones sobre el regreso de personas al lugar de trabajo".
Tales pruebas son más útiles para comprender la epidemiología del virus, no para tomar decisiones individuales, dijo la Dra. Mary Hayden, directora de la división de microbiología clínica de los Laboratorios Médicos Rush en Chicago. Incluso las mejores pruebas aún no pueden responder la pregunta crucial sobre si los anticuerpos confieren inmunidad contra futuras infecciones por COVID, dijo Hayden.
"El mejor escenario posible es que las personas se infecten y tengan inmunidad protectora durante mucho tiempo", dijo. "Que sería increíble. Pero simplemente no tenemos eso en este momento ".
Pero una gran cantidad de pruebas que se presentan a los consumidores prometen explícitamente resultados destinados a permitir el regreso al trabajo, la escuela y otros ámbitos sociales.
Las pruebas ofrecidas por Since Health se encuentran entre cientos producidas desde marzo, desde las ofrecidas por laboratorios comerciales y centros de investigación académica hasta pequeños desarrolladores que buscan mantenerse en el lucrativo mercado provocado por una pandemia global. Debido a que Health está usando dos pruebas de anticuerpos en conjunto, una de las cuales recibió autorización de uso de emergencia el 29 de mayo; el otro aún está pendiente.
Anders Boman, hijo del director médico y cofundador de Since Health, dijo que hasta que se produjo la crisis COVID, la compañía, que se lanzó en Seattle el año pasado, se centró en "un nicho de atención integral y salud sexual", que incluye Tratamientos hormonales para hombres y mujeres.
"Los consumidores no están preocupados por la salud sexual en este momento", dijo Boman, explicando el cambio de enfoque. "Les preocupa cómo volver al trabajo, cómo volver a la normalidad y ¿están a salvo?"
La FDA normalmente sigue un estricto proceso de aprobación de pruebas para detectar enfermedades, a menudo un esfuerzo costoso que puede llevar meses o años. Por lo general, eso requiere una validación independiente de la precisión de las pruebas. Pero después de ser criticada por el despliegue torpe de las pruebas de diagnóstico durante el inicio de una pandemia global, la FDA giró con fuerza en la otra dirección, renunciando a sus requisitos habituales y permitiendo a las empresas lanzar pruebas autovalidadas al mercado.
"Ellos relajaron toda la supervisión reguladora", dijo Hayden.
Varios expertos entrevistados por Kaiser Health News dijeron que la FDA enfrentó una tremenda presión política para que las pruebas de anticuerpos estuvieran disponibles.
"Fue realmente una sola presión, y ese fue el hecho de que la incapacidad original para obtener una prueba [de diagnóstico] en el mercado en los EE. UU. A medida que aumentaba el brote significa que estaban tratando de hacer básicamente todo lo posible para sacarlos". dijo Michael Osterholm, director del Centro de Investigación y Política de Enfermedades Infecciosas de la Universidad de Minnesota.
Las reglas relajadas generaron preocupación en el Congreso, donde un subcomité del Comité de Supervisión y Reforma detalló el fracaso de la FDA para "vigilar el mercado de prueba". Grupos como la Asociación de Laboratorios de Salud Pública también plantearon preguntas. Scott Becker, director ejecutivo de APHL, dijo que habló con altos funcionarios del Departamento de Salud y Servicios Humanos de EE. UU. A principios de abril.
"Simplemente nos soltamos y dijimos: 'Esta es una política realmente mala'", dijo Becker. “'Nos vamos a inundar y vamos a perder el control de calidad. No vamos a saber qué hacer con los resultados ".
Eso es exactamente lo que ha sucedido, dijo Osterholm. "La FDA necesita aportar mucha más disciplina a esta área y deben articularla claramente", dijo.
Una cuestión clave es la precisión de las pruebas, que se basan en medidas conocidas como sensibilidad y especificidad. Una prueba altamente sensible capturará todos los resultados positivos verdaderos. Una prueba altamente específica identificaría todos los resultados negativos verdaderos.
En abril, investigadores de la Universidad de California-San Francisco, dirigidos por el inmunólogo Dr. Alexander Marson, analizaron 14 pruebas serológicas de COVID-19 en el mercado y descubrieron que todos menos uno arrojaron resultados falsos positivos, lo que indica que alguien tenía anticuerpos contra el coronavirus cuando en realidad no lo hicieron. Las tasas de falsos positivos alcanzaron hasta el 16% en el estudio, que aún no ha sido revisado por pares.
Resultados poco confiables preocupan al Dr. Jeff Duchin, el oficial de salud pública de Seattle y el condado de King, Washington, donde surgió el primer aumento de casos de COVID en los EE. UU. Una persona que da positivo por anticuerpos que no existen puede creer erróneamente que él o ella libre de ignorar la orientación sobre la prevención de infecciones, posiblemente propagando la enfermedad. "Independientemente de si su resultado es positivo o negativo, el lugar de trabajo aún debe tomar medidas", dijo. "No deberían pensar que un programa de prueba de ninguna manera los libera de esa responsabilidad".
Funcionarios de la FDA dijeron que ahora están trabajando con el Instituto Nacional del Cáncer para validar de forma independiente las pruebas de serología en el mercado. Hasta que esa lista sea pública, los usuarios deben confiar en los relativamente pocos que han recibido las autorizaciones de uso de emergencia hasta la fecha. Más de 190 personas más han solicitado esa autorización, pendiente de revisión por parte de la FDA.
Pero los consumidores pueden tener poco control, porque lo más probable es que obtengan pruebas de sus empleadores o médicos, con poca comprensión de por qué se eligieron esos productos.
"No hay un estándar nacional, no hay una ventanilla única o un Consumer Reports para las pruebas de anticuerpos", dijo Becker. "No espero que un miembro del público pueda resolver esto".
Incluso los médicos expertos pueden tener problemas. US Acute Care Solutions, un grupo de servicios médicos propiedad de un médico, estaba probando una prueba hecha en China suministrada por Premier Biotech, con sede en Minneapolis, con planes de evaluar a su personal de más de 3,500 médicos y empleados, dijo el director médico del grupo, Dr. Amer Aldeen. Esa prueba ha sido ampliamente utilizada, incluso en recientes encuestas de serología controvertidas realizadas por la Universidad de Stanford y la Universidad del Sur de California .
Cuando USACS lo usó, la prueba Premier no detectó anticuerpos en varios empleados que habían estado enfermos y dieron positivo para el coronavirus en las pruebas de diagnóstico, dijo Aldeen. Los resultados podrían haber sido causados por instrucciones defectuosas en lugar de fallas en la prueba en sí, dijo. Aún así, la prueba Premier no recibió la autorización de la FDA y los resultados le dieron pausa.
"No sirve de nada seleccionar una prueba que no esté aprobada por la FDA", dijo.
En un comunicado, los funcionarios de Premier Biotech dijeron que anticipan exceder los estándares de la FDA, que exigen pruebas que sean al menos 90% precisas para identificar anticuerpos positivos en una muestra y 95% precisas para identificar muestras que no contienen anticuerpos.
Algunos podrían preguntarse por qué la FDA no solo identificó varias pruebas de anticuerpos confiables y exigió su uso para evitar el caos. Un funcionario de la FDA dijo que hacer ese tipo de elección estaría fuera del alcance de las responsabilidades de la agencia.
"La vía de la FDA es revisar estas pruebas y asegurarse de que sean seguras y precisas para el pueblo estadounidense", dijo la portavoz Emma Spaulding. "No estaría dentro de nuestro carril decir qué prueba debe usarse".
Aunque los funcionarios de salud entienden el deseo de una prueba que pueda proporcionar comodidad en medio de la incertidumbre de COVID-19, Duchin aconsejó a los empleadores y consumidores que esperen un poco más.
"Hay costos en las pruebas con pruebas no validadas que podrían superar los beneficios de satisfacer su curiosidad", dijo.


